2023年11月21日,云南大学生物医药研究院陈大华教授团队联合中国科学院动物研究所孙钦秒研究员团队在《Nature Communications》杂志上发表了题为“PTK2B promotes TBK1 and STING oligomerization and enhances the STING-TBK1 signaling”的研究论文。该研究揭示了蛋白酪氨酸激酶2β(PTK2B)在抗病毒天然免疫反应中发挥着重要的作用。PTK2B可以与TBK1和STING相互作用,分别以激酶活性依赖和非依赖的方式促进TBK1和STING的寡聚化,进而增强STING-TBK1的信号转导,以确保有效的抗病毒免疫应答。

TANK结合激酶1(TBK1)是调节抗病毒先天免疫反应中的关键激酶,具有促使IRF3/7磷酸化、诱导其二聚化和核转位,进而诱导I型干扰素(IFNs)产生的功能。先前的研究指出,TBK1的磷酸化可能通过改变其结构构象来调节寡聚体的形成,从而影响其活性。然而,关于TBK1磷酸化与寡聚体形成之间确切的调控关系目前仍然不清楚。
在本研究中,研究人员发现PTK2B作为TBK1相互作用的蛋白,促进TBK1的寡聚化。功能实验表明,PTK2B缺失降低了小鼠胚胎成纤维细胞、巨噬细胞和树突状细胞中的抗病毒免疫反应;小鼠活体实验也发现PTK2B缺失使小鼠更容易受到病毒感染,导致更高的死亡率。在调控机制层面上,研究人员发现PTK2B直接磷酸化TBK1的Tyr591残基,从而增强了TBK1的寡聚化和活性。此外,研究人员还发现PTK2B也能与干扰素基因的刺激因子(STING)相互作用,并能以非依赖激酶活性的方式促进其寡聚化。总而言之,PTK2B通过不同的机制增强了TBK1和STING的寡聚化,进而促进了STING-TBK1通路的激活,以确保有效的抗病毒先天免疫应答。这些研究成果不仅揭示了PTK2B通过促进STING-TBK1信号通路的激活以确保高效抗病毒反应的机制,而且为自身免疫性疾病的治疗提供了线索。
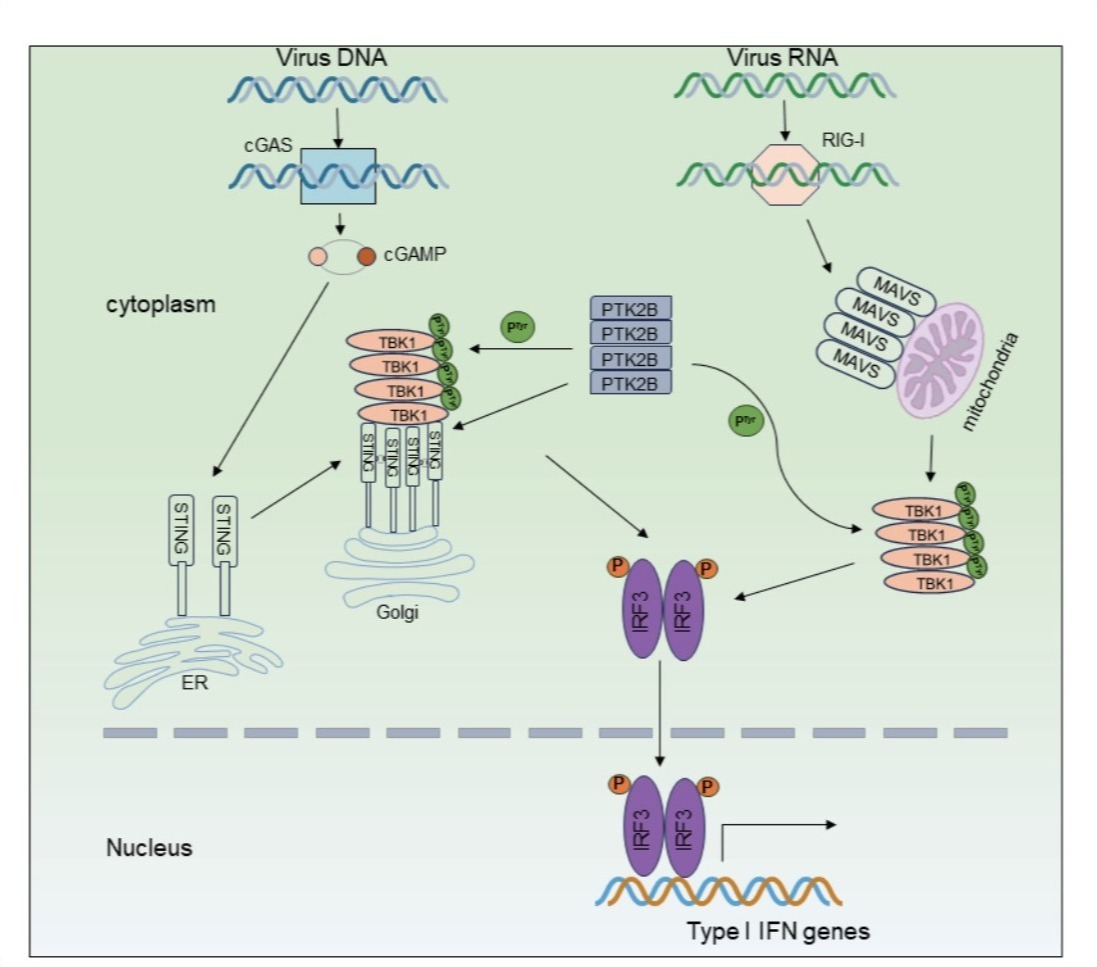
PTK2B调控STING-TBK1信号转导模式图
中科院动物研究所博士研究生林永芳、杨静为论文的并列第一作者,中科院动物研究所孙钦秒研究员、云南大学陈大华教授为论文的共同通讯作者。本工作得到国家自然科学基金资助项目、国家自然科学基金基础科学中心项目和膜生物学国家重点实验室开放项目的资助。
论文链接:
https://www.nature.com/articles/s41467-023-43419-4