北京时间2022年9月6日,Cell Reports在线发表了云南大学生物医药研究院陈大华实验室和中国科学院动物研究所孙钦秒实验室合作完成的关于Ku蛋白调控cGAS-STING信号通路的最新研究论文。
该研究详细解析了Ku蛋白作为共同受体通过促进cGAS结合DNA和cGAS聚集体的形成,进一步增强cGAS的酶活从而正调控cGAS-STING信号通路的激活。
孙钦秒研究员与陈大华教授为该文的共同通讯作者,中国科学院动物研究所博士研究生陶新月与云南大学硕士研究生宋佳丽为共同第一作者。
天然免疫反应的启动依赖于多种模式识别受体对不同种病原体的识别。在众多被发现的识别DNA病毒的受体中只有环状GMP-AMP合成酶(cGAS)的功能不受限于DNA序列与细胞种类,是公认的广谱的胞质DNA识别受体。在机体抗DNA病毒和细菌的天然免疫反应中发挥着重要的作用。
cGAS在结合DNA后会发生二聚化,形成聚集体,并促进合成第二信使cyclic GMP-AMP(cGAMP)。cGAMP结合并激活接头蛋白STING,STING进一步激活下游信号通路最终促进一型干扰素与炎症因子的产生。尽管cGAS被鉴定为一个重要的DNA识别受体,然而cGAS与DNA结合的能力却相对较弱,cGAS如何能够高效地识别广泛的DNA配体并激活复杂的天然免疫信号通路的机制尚不清楚。
cGAS相对较低的DNA结合力预示着或许存在其它的DNA识别受体帮助并协同cGAS完成天然免疫的激活。针对这一科学问题,研究人员首先通过质谱与免疫共沉淀相结合的方法筛选出与cGAS有相互作用的蛋白,其中Ku蛋白(Ku80与Ku70)吸引了研究人员的注意。Ku70、Ku80及催化亚基DNA-PKcs可以构成异源三聚体DNA-PK复合体。其中Ku70与Ku80可以构成异源二聚体,Ku蛋白。Ku蛋白可以识别并结合DNA,且具有较强的DNA结合力,并被报道在细胞质中可以作为DNA病毒的识别受体参与天然免疫反应,然而对其调控的分子机制并不很清楚。
为了进一步验证Ku蛋白在抗DNA病毒的天然免疫反应中的调控作用,研究人员首先通过敲低与敲除实验发现Ku蛋白表达的减少和缺失能够显著降低cGAS-STING介导的天然免疫反应的活性。进一步通过荧光素酶报告基因实验发现过表达Ku蛋白只能够促进共转cGAS与STING诱导的ISRE的活性,而不能促进单独转染STING诱导的活性。同时发现过表达或敲低Ku蛋白并不影响cGAMP诱导的IFNB1的产生。此外,在cGAS敲除的细胞系中发现进一步敲低Ku蛋白后,HSV-1病毒诱导的IFNB1产生并没有受到影响。综合这些功能实验的结果发现Ku蛋白是通过作用于cGAS来发挥正调控作用的。
在探究Ku蛋白对cGAS调控的具体机制方面,研究人员发现Ku蛋白促进cGAS结合DNA的能力,并显著增强cGAS聚集体的形成,进而促进了cGAS 的酶活,诱导产生更多的cGAMP。此外,研究者还发现在缺乏DNA-PKcs的情况下Ku蛋白仍然增强cGAS的功能。
综上所述,该研究发现Ku蛋白作为cGAS重要的共同受体能够促进cGAS结合DNA和聚集体的形成,显著增强了cGAS的酶活,进而促进cGAS-STING信号通路的活性。为cGAS介导的天然免疫信号通路的调控机制提供了新的思路。
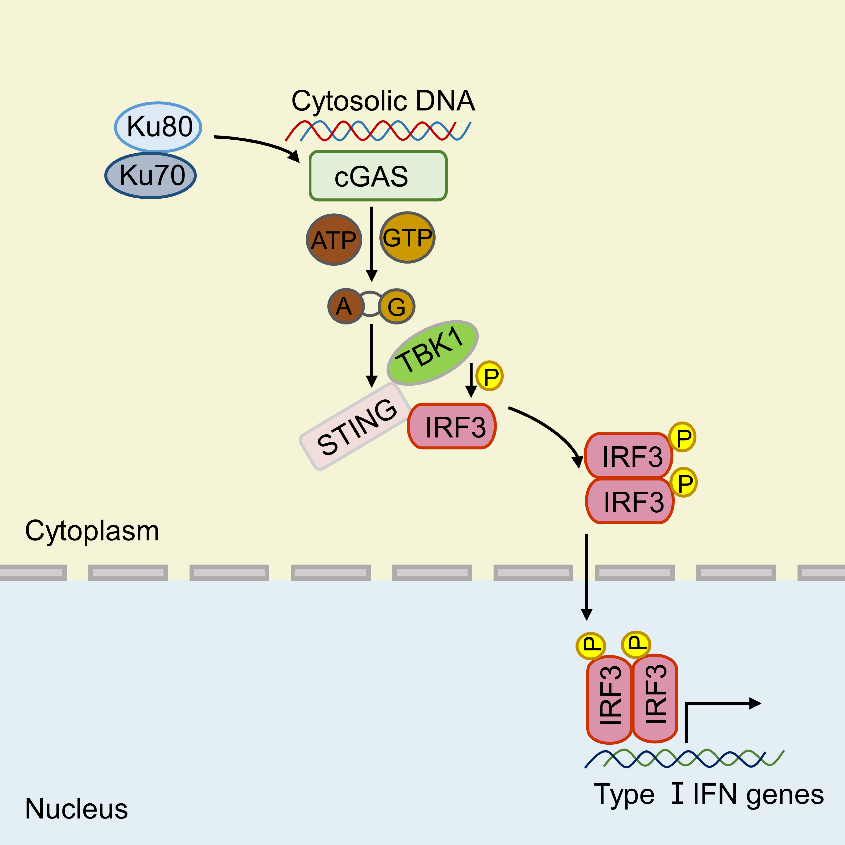
图示:Ku蛋白通过促进cGAS与DNA的结合调控cGAS-STING信号通路