2022年3月23 日,Molecular Cell在线发表了云南大学生物医药研究院陈大华团队完成的关于AGO蛋白调控新生多肽泛素化的最新研究论文。该研究详细阐述了AGO蛋白在内质网上发生相分离并且招募E3泛素连接酶Ltn1来参与新生多肽泛素化的调控。

真核细胞内,基因表达受到严格而精准的调控。miRNA介导的转录后调控和泛素-蛋白酶体介导的蛋白翻译后调控在基因表达的调控中发挥重要的作用。这两种调控方式是否存在协同机制以保证基因表达有效进行,一直是人们探索的问题。
MicroRNA是一种长度20~23个核苷酸的非编码RNA,通过与AGO蛋白结合形成沉默复合体(RISC)来调控靶mRNA的翻译,是细胞质内常见的转录后调控方式之一。曾有研究报道AGO蛋白可以定位到内质网上并通过miRNA来调控基因的表达。由于内质网是蛋白合成的重要场所,因此研究人员推测AGO蛋白可能以一种新的方式在蛋白水平上调控基因表达。为研究定位于膜上AGO蛋白的功能,研究人员通过酵母双杂交筛选到一个名为VCP的AGO互作蛋白,并发现敲低vcp可以增强AGO/miRNA介导的基因沉默活性,进一步的研究发现AGO蛋白沉默活性的增强是由于AGO蛋白在内质网上的分布增多导致。这表明内质网可能是AGO蛋白发挥功能的一个重要场所。接下来,研究人员对AGO蛋白在内质网定位的机制进行了探索。首先,通过对AGO家族蛋白的特征分析,研究人员发现AGO蛋白普遍具有很高的等电点,在生理条件下会带有很强的正电荷,这暗示AGO蛋白可能会结合膜上带有相反电荷的磷脂。研究人员通过检测AGO蛋白与多种磷脂的结合能力,发现AGO蛋白可以通过N结构域结合PI4P和PI(4,5)P2,其中与PI(4,5)P2结合能力最强。为进一步验证两者的结合,研究人员在体外制备了巨大磷脂囊泡(GUV),GUV具有与细胞膜相似的磷脂双分子层结构,因此可以在体外模拟蛋白与膜结合的生物学过程。研究发现AGO蛋白可以与PI(4,5)P2存在的GUV结合并进一步发生相分离。此外,研究人员利用超高分辨率显微镜在活体细胞中实时观察到了AGO蛋白在内质网上的相分离过程。以上结果说明了AGO蛋白可以通过结合PI(4,5)P2在内质网膜上发生相分离(图1)。
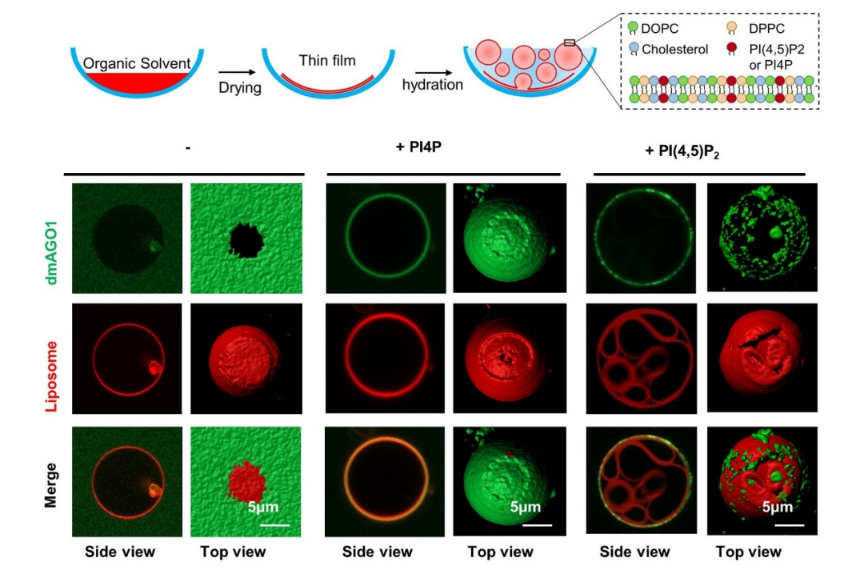

图1:AGO蛋白通过结合PI(4,5)P2发生相分离
为了解析内质网上AGO发生相分离的生物学功能,研究人员利用miRNA报告系统,对VCP的cofactors进行了筛选,发现敲低Ufd1和Npl4能产生与敲低vcp相似的增强AGO/miRNA介导的基因沉默活性。已有研究表明,VCP-Ufd1-Npl4形成的三元复合物,在内质网上主要是通过将泛素化标记的蛋白运输到蛋白酶体来参与蛋白质量控制。因此,在细胞中敲低vcp,会导致泛素化蛋白的在内质网的累积。有趣的是,研究人员发现同时敲低vcp和Ago1,会减弱这种泛素化蛋白的累积。这些结果表明AGO1蛋白也参与了VCP-Ufd1-Npl4在内质网上蛋白质量控制的调控。VCP-Ufd1-Npl4形成的三元复合物,在内质网上主要参与内质网相关降解(ER-associated degradation,ERAD)与核糖体质控(Ribosome quality control,RQC)的调控,而AGO蛋白又可以结合在内质网上的核糖体上,因此,研究人员推测AGO蛋白可能会参与RQC的调控。通过对新生多肽泛素化水平的检测,研究人员发现敲低vcp可以显著增强新生多肽的泛素化,同时敲低vcp/Ago1可以明显减少新生多肽的泛素化,这表明内质网上定位的AGO蛋白复合物确实参与了RQC过程中新生多肽的泛素化。同时,Ago1敲低引起新生多肽泛素化水平的降低也表明内质网AGO蛋白复合物可能具有E3泛素连接酶的活性。
进一步,研究人员利用亲和质谱(AP-MS)技术筛选到了一个存在于内质网上AGO蛋白复合物中的E3泛素连接酶Ltn1。为了更深入地解析AGO/Ltn1复合物如何调控新生多肽的泛素化,研究团队分别利用免疫共沉淀、免疫荧光染色以及ddFP系统发现AGO蛋白与Ltn1蛋白存在着直接的相互作用。此外,研究人员通过构建MS2-MCP和Suntag两个系统相结合的单分子荧光报告系统并结合超高分辨显微镜在活细胞中同时观察到了AGO蛋白、Ltn1蛋白、目的基因的mRNA以及正在翻译的新生多肽。
综上,研究团队通过利用多种手段,包括一系列生化、细胞及遗传实验,发现AGO蛋白通过其N结构域内保守的结构域与分布在内质网上的PI(4,5)P2结合并发生相分离形成聚集颗粒,这种聚集可以招募E3泛素连接酶Ltn1,对新生成的多肽进行泛素化标记,随后协同VCP-Ufd1-Npl4复合物将泛素化的新生多肽转运至蛋白酶体进行降解,从而实现对基因表达的精准调控。
该项目得到国家自然科学基金委科学基础中心和科技部重点研发项目和云南省万人计划等项目支持,陈大华教授与中科院动物所孙钦秒研究员为该文的共同通讯作者,云南大学高亚杰博士和朱元祥博士为共同第一作者。
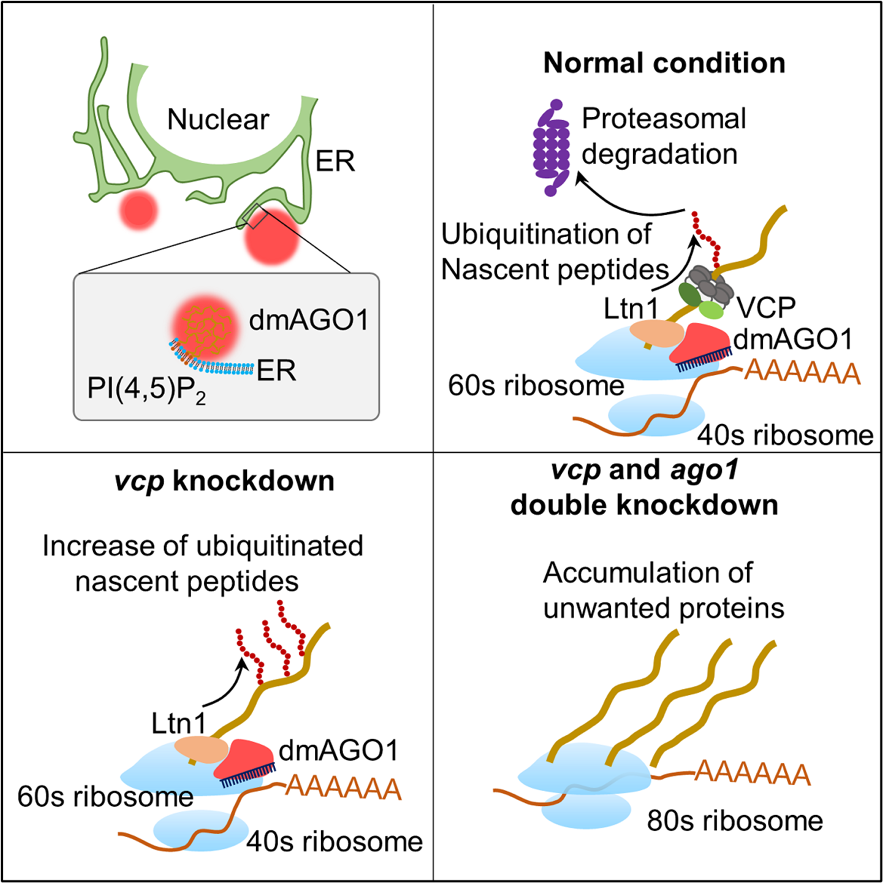
图文摘要