近日,云南大学生物医药研究院陈大华教授和中国科学院动物研究所孙钦秒研究员受邀在Cell Press细胞出版社期刊Trends in Cell Biology发表了题为“Argonaute-dependent ribosome-associated protein quality control”的综述。该论文全面总结了核糖体相关蛋白质量控制(ribosome-associated protein quality control, RQC)途径的具体过程和分子机理,系统归纳了Argonaute(AGO)蛋白在miRNA介导的基因沉默途径中的功能,并对内质网上定位的AGO蛋白,在RQC途径与miRNA介导的基因沉默途径偶联过程中,作为桥联蛋白的功能与机制进行了深入的讨论,提出了Argonaute蛋白依赖的核糖体相关蛋白质量控制系统的新概念。

基因表达是遗传信息从DNA传递到蛋白质的生物学过程,主要包括DNA的转录和mRNA的翻译,转录是遗传信息从DNA转移到RNA的过程,而翻译是RNA信息流向蛋白质的过程。基因表达的调控即对从DNA到蛋白质的生物学过程的调节和控制。真核细胞在转录、转录后、翻译以及翻译后多个层次上进化出一系列机制来调控基因的表达。AGO/miRNA介导的基因沉默和泛素介导的蛋白质量控制 (protein quality control, PQC) 分别是转录后以及翻译后水平基因表达调控的两种重要机制。细胞受到外界信号刺激时,通过这些保守的机制来改变基因表达的状态,从而维持细胞的稳态。AGO/ miRNA介导的基因沉默和PQC的调控异常,会导致多种疾病甚至肿瘤的发生。
内质网(endoplasmic reticulum,ER)作为细胞内富含核糖体的细胞器,是分泌蛋白和膜蛋白的翻译的重要场所。当细胞处于应激状态时,AGO/ miRNA介导的基因沉默以及RQC会在ER上同时发生。我们先前的研究发现,这两种基因表达的调控方式可以通过ER定位的AGO蛋白进行偶联。AGO蛋白通过与磷脂PI(4,5)P2的互作,在ER上发生相变,招募E3泛素连接酶Ltn1,从而调控RQC过程中新生肽的泛素化,实现基因表达的精密调控。
AGO蛋白调控新生多肽泛素化的发现扩展了我们对AGO蛋白的认知。AGO蛋白除了可以通过miRNA靶向mRNA外;还可以协同Ltn1降解细胞内非必需的蛋白产物。AGO蛋白这一新功能的发现,引申出了一个重要的科学问题:即AGO蛋白如何通过Ltn1来调控新生多肽的泛素化?
Ltn1作为新生多肽泛素化的E3泛素连接酶,同时与AGO蛋白存在相互作用;AGO蛋白作为miRNA/RISC的核心效应蛋白,也参与Ltn1介导的新生多肽泛素化。这些结果表明,可能存在一种AGO蛋白依赖的RQC。
之前已有研究表明,AGOs/miRNAs和核糖体停滞之间存在联系。当AGO/RSIC结合在mRNA的编码区时,直接导致核糖体停滞。在植物中,有许多miRNAs靶向编码区,但只有少数miRNA结合位点可导致核糖体停滞,表明miRNA介导的核糖体停滞可能还需要其他因素参与。最新的研究发现,双链RNA结合蛋白SGS3与AGO/RISC中miRNA的3‘ 端直接相互作用,引起核糖体停滞,进而促进靶标mRNA的切割,导致更过次级siRNA的产生。在动物中,FMRP作为核糖体相关的RNA结合蛋白(RNA binding protein,RBP),可与AGO结合,参与翻译抑制。有报道称在小鼠大脑组织中,FMRP蛋白会结合到其靶mRNA的编码区,导致核糖体停滞。mRNA的3’-UTR是调控其翻译效率、稳定性和亚细胞定位的关键元件,它们可以通过与不同的RBP相互作用,实现多种调控功能。在AGO依赖的RQC中,AGO靶向的mRNA的3’-UTR在AGO依赖的RQC中可能发挥重要的作用。
基于以上研究进展以及我们对AGO蛋白调控新生多肽泛素化功能的发现,我们提出了AGO蛋白依赖的核糖体相关蛋白质量控制系统的新概念(图1)。AGO蛋白通过与RBP作用,导致核糖体停滞,或招募Ltn1到核糖体的60S亚基上,参与RQC的调控。
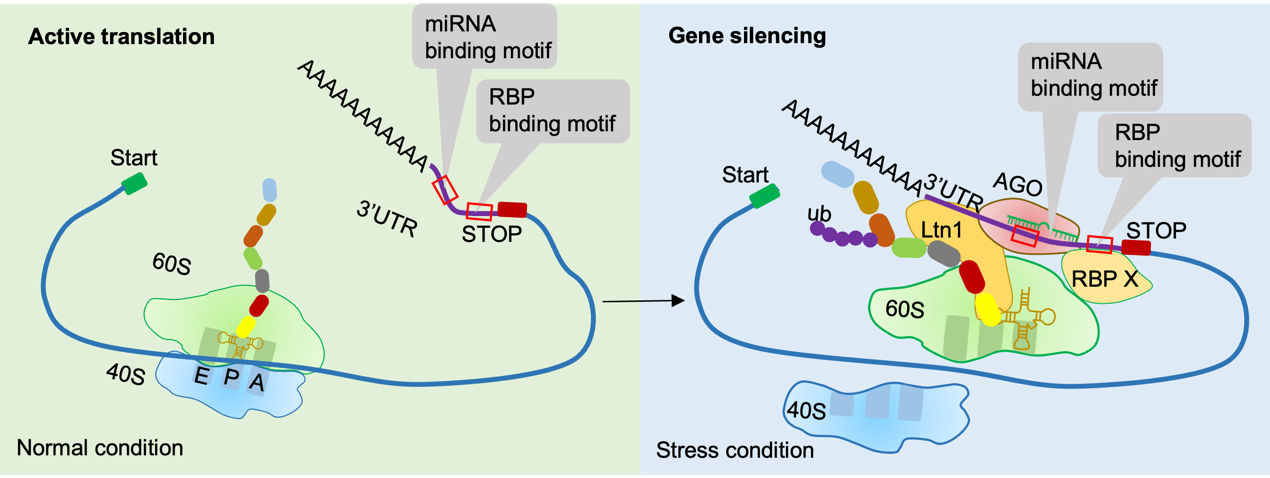
图1 AGO蛋白调控RQC的潜在机制